2020 年 02 月 21 日讯 / 生物谷 BIOON/ --BioMarin 是一家全球性的生物技术公司,专注于开发治疗严重且危及生命的罕见和超罕见遗传疾病的创新疗法。近日,该公司宣布,美国食品和药物管理局(FDA)已受理其提交的生物制品许可申请(BLA),该 BLA 寻求批准其 AAV5 基因疗法 valoctocogene roxaparvovec(valrox,BMN270),用于 A 型血友病成人患者的治疗。此次 FDA 受理,标志着在美国首次受理了针对任何类型血友病基因治疗产品的上市申请。
FDA 已对 valrox BLA 授予了优先审查,并已指定处方药用户收费法(PDUFA)目标日期为 2020 年 8 月 21 日。FDA 已通知 BioMarin 公司,目前不打算召开咨询委员会会议讨论这一申请。在欧盟,欧洲药品管理局(EMA)也已受理了 valrox 治疗重度 A 型血友病成人患者的营销授权申请(MAA),并于 2020 年 1 月开始在加速评估程序下审查,这也是在欧洲进入审查的针对任何类型血友病基因治疗的第一份上市申请。
这意味着,如果获得批准,valrox 将成为全球第一种治疗任何类型血友病的基因疗法。此前,valrox 已被 FDA 授予突破性药物资格(BTD)、被 EMA 授予优先药物资格(PRIME)、被 FDA 和 EMA 授予了孤儿药资格(ODD)。
此外,FDA 还受理了 AAV5 总抗体检测产品的上市前批准(PMA)申请,该产品拟作为 valrox 的伴随诊断检测产品,也是第一个用于基因疗法的伴随诊断检测产品。由于对 AAV5 存在预先免疫性(pre-existing immunity)的流行率较低,BioMarin 估计美国约 80% 的 A 型血友病患者对 AAV5 没有预先免疫性。如果患者对 AAV5 存在预先免疫性,则将不符合 AAV5 介导性基因治疗的资格。
A 型血友病也被称为因子 VIII(FIII)缺乏或经典血友病,是一种由凝血因子 VIII 缺失或缺陷引起的 X 连锁遗传病,患者会反复发生持续或自发性出血,特别是在关节、肌肉或内脏器官中,长期可导致残疾。
目前,重度 A 型血友病的护理标准是每周 2 - 3 次静脉输注凝血因子 VIII 的预防性治疗方案。
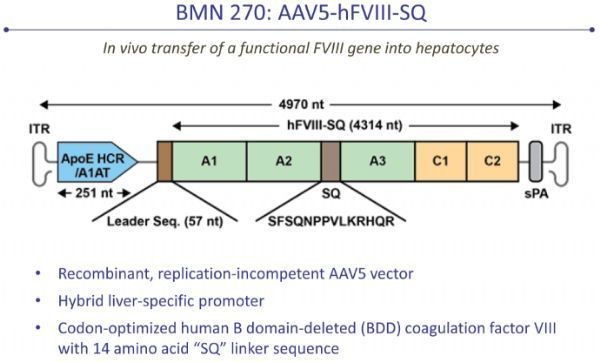
valoctocogene roxaparvovec(valrox)是一种基于腺相关病毒(AAV)的基因疗法,开发用于 A 型血友病的治疗。该疗法通过向患者体内递送凝血因子 VIII 功能基因,恢复 VIII 的产生,从而消除或减少静脉 VIII 输注需求。如果获批,valrox 将标志着 A 型血友病治疗的一个重大里程碑,这种开创性的疗法,有潜力使患者实现“一劳永逸”的治疗效果。
2019 年 5 月底,BioMarin 公司宣布,valrox 治疗重度 A 型血友病达到了美国和欧盟监管审查的预先规定的临床标准。截至 2019 年 5 月 28 日,在 III 期 GENEr8- 1 研究的 20-patient 队列中,有 8 例患者在第 23-26 周时达到凝血因子 VIII 活性水平≥40 国际单位 / 分升(IU/dL)的预先规定标准。
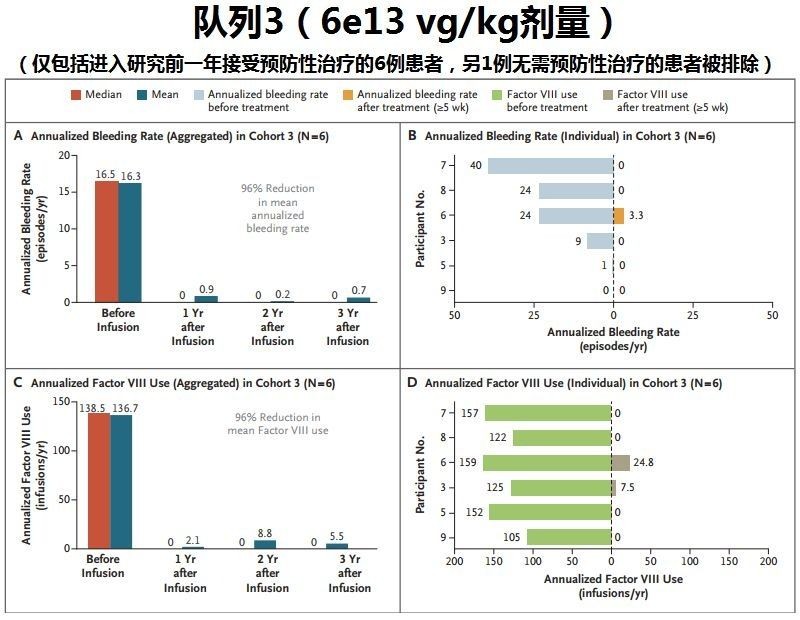
2019 年 7 月,在第 27 届国际血栓与止血学会(ISTH)2019 年大会上,BioMarin 公司公布了正在进行的 I /II 期研究 6e13 vg/kg 剂量队列的最新数据。
结果显示,单次给药 valrox 后,出血率控制和因子 VIII 使用减少在第三年继续维持。在研究开始前,患者平均年出血率(ABR)为 16.3 次、中位 ABR 为 16.5 次;三年后,平均 ABR 降至 0.6 次,中位 ABR 为 0。这意味着,患者的平均 ABR 降低了 96%,目标关节出血 100% 消除。在三年内,患者平均年化因子 VIII 使用率也降低了 96%,所有患者继续保持无需因子 VIII 预防性治疗。患者因子 VIII 水平在三年内维持足以达到显著的止血效果。因子 VIII 的表达已经进入一个平稳期,下降的速度已经大大减缓,这可能实现持久的、长期的表达。(来源生物谷)
原文出处:BioMarin's Biologics License Application for Valoctocogene Roxaparvovec Accepted for Priority Review by FDA with Review Action Date of August 21, 2020


